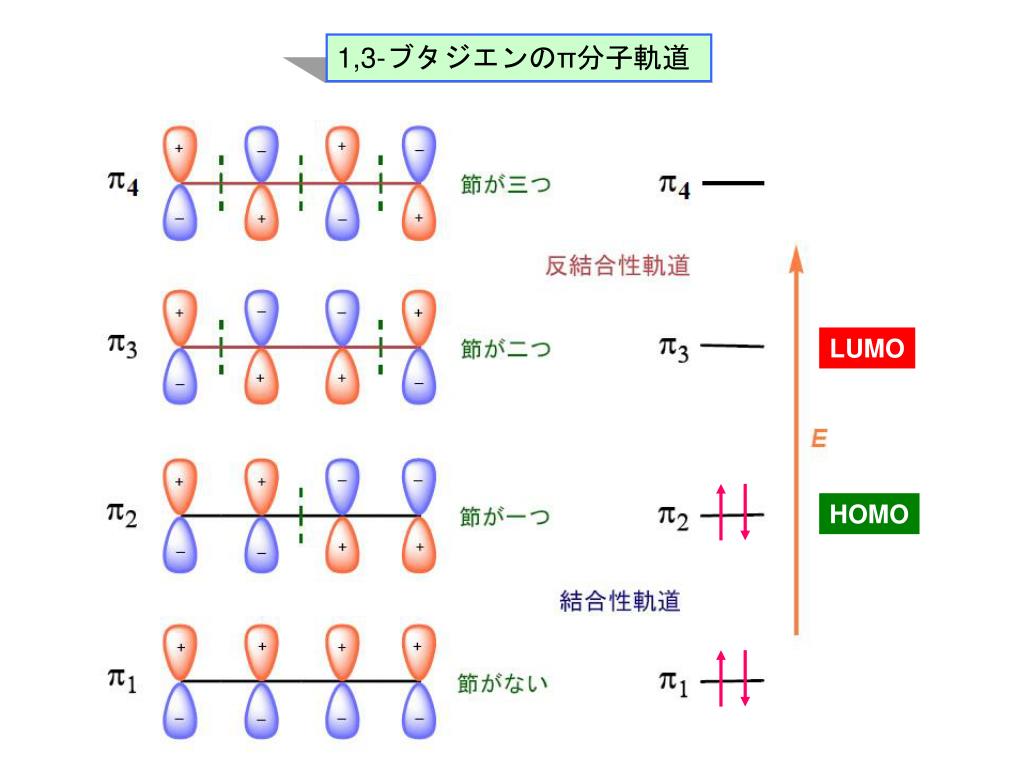
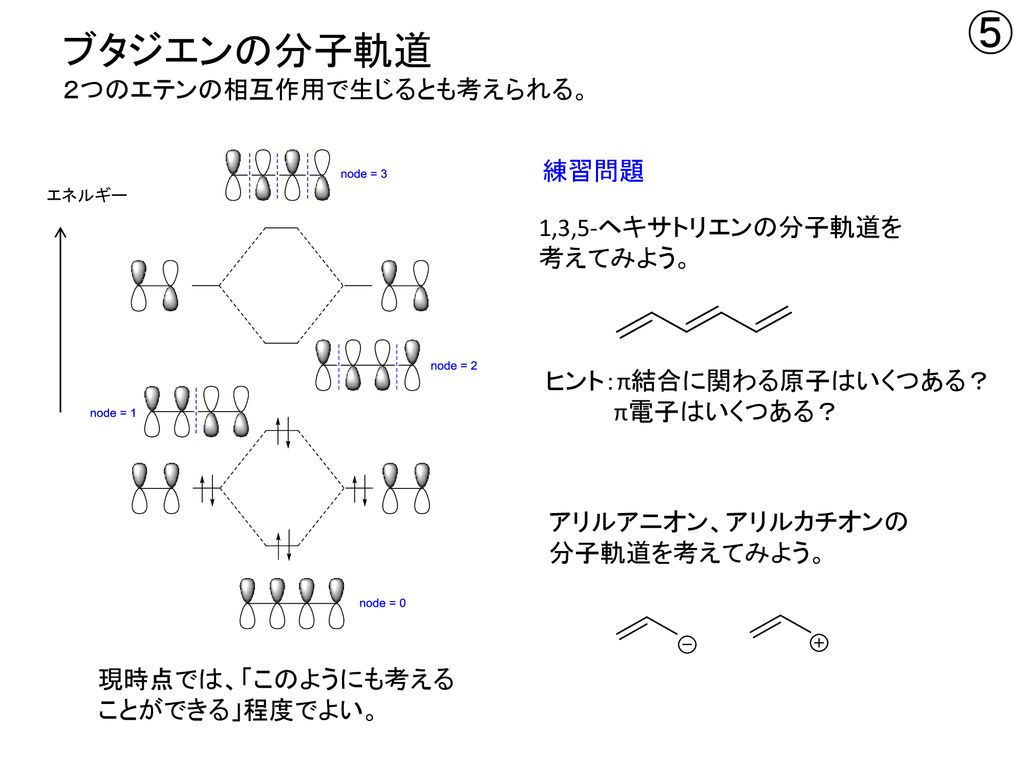
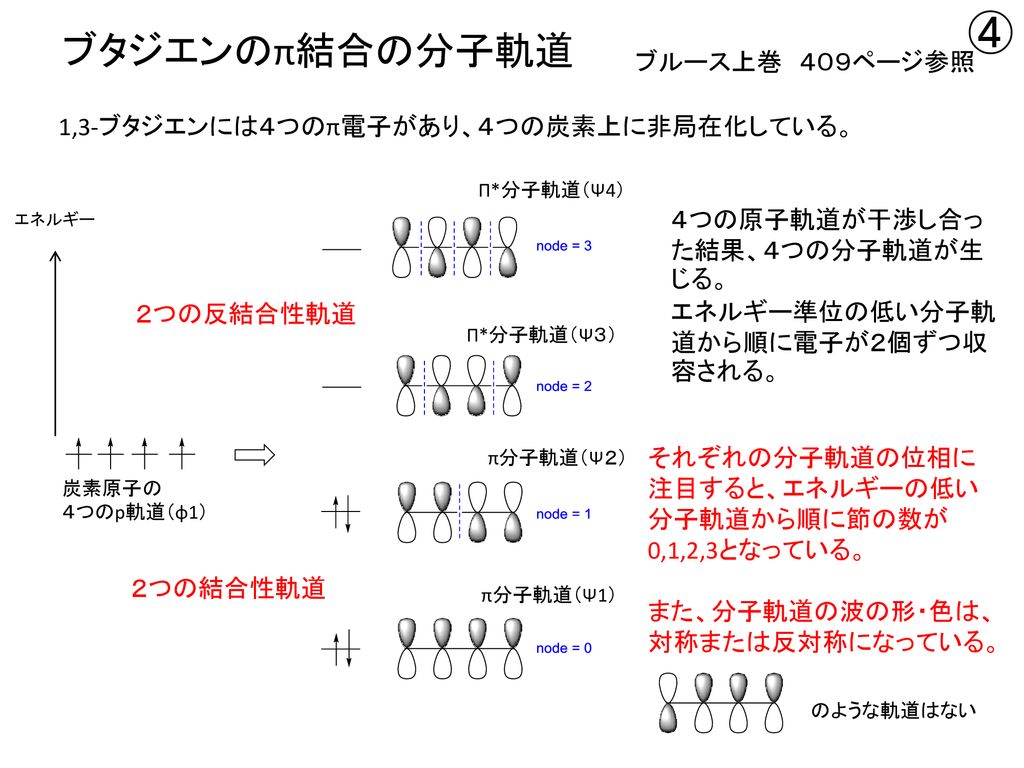
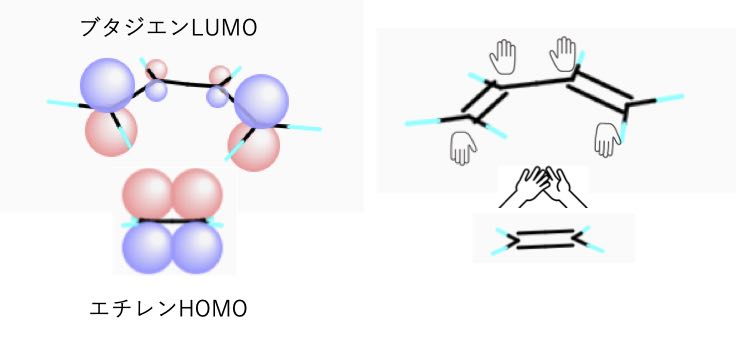
図4.1,3ブタジエンとジエンの軌道相互作用 図5.dieneとdienophileのエネルギー相関図 2.DielsAlder反応 フロンティア軌道を用いた反応予測は芳香族の置換反応 のみでなく、DielsAlder反応のような2分子間の軌道の位 相の関係する反応に対しても有効である。 ジエン(または1,3双極子)とジエノフィルの分子軌道 LYP/631G* 法により計算 First version , Revised version1,3ブタジエンは、共役二重結合を持つ最も単純な分子である。 1,3ブタジエンのπ分子軌道についても、C1~C4の2p z軌道がすべて相互作用して、 新しい分子軌道を4つ作ると考える。分子軌道の形とエネルギーは、下の図のようにな あることがわかっている。
キリヤ Q A
1 3-ブタジエン 分子軌道
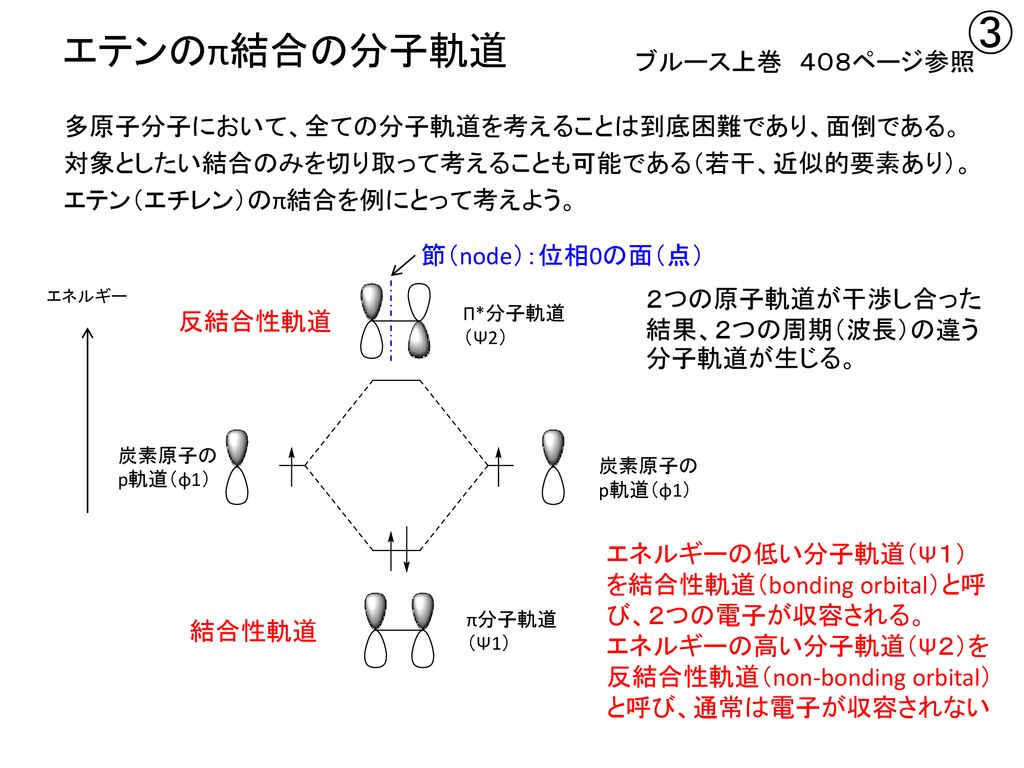
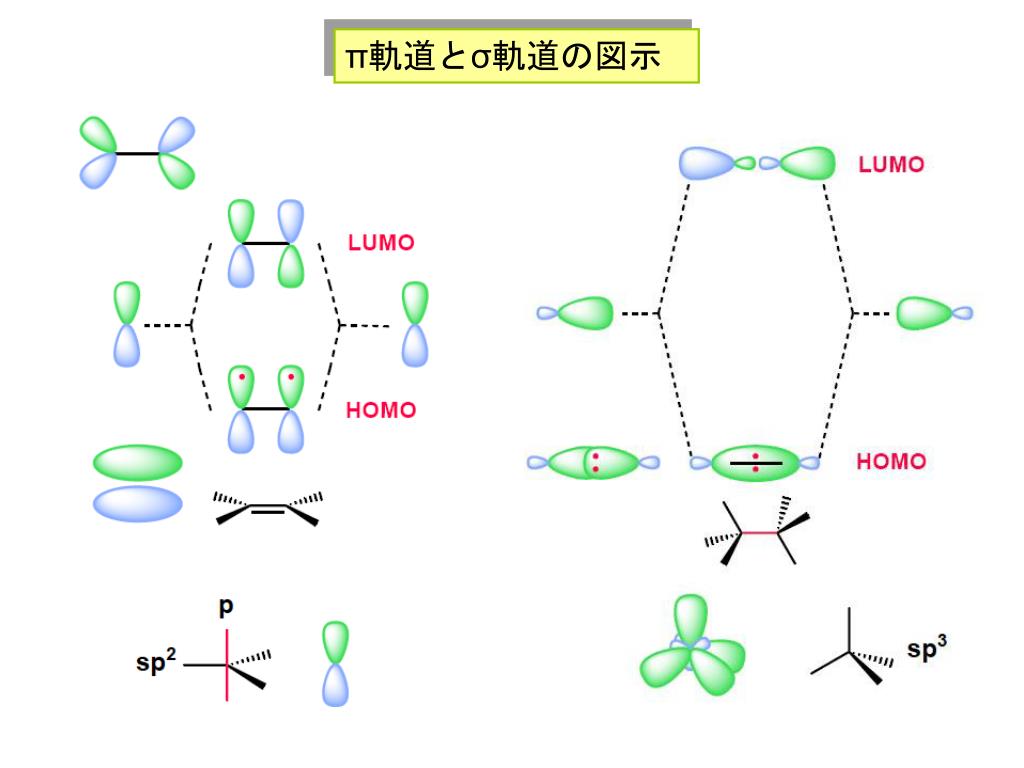
1 3-ブタジエン 分子軌道-1 2 αβ π i2) ヒュッケル分子軌道沵を用いて,h 3 がより安定なのは直線状態と三角形状態の どちらであるか決定せよ。h 3, h 3 –ではどうか。 x =(α−e) βとおくと、直線状態、三角形状態の軌道エネルギーは 直線状態 α β αβ α β 2 2 2 0 0 1 1 1 1 0 3 2 1 3 = −1 共役系の分子軌道 1 エチレンの分子軌道-p 電子近似 エチレン分子は、322~4 で述べたように、炭素原子軌道がsp2 混成をしてお り、図1 に示すように、平面内にあるs 分子軌道と、面外に突き出たp分子軌道 が形成される。分子面外に飛び出したp



2
ブタジエン 分子軌道 ブタジエン 分子軌道 分子の場合にも同様なことがあてはまる分 子の有す る電子のエネルギーは,分 子軌道法を用いるとやはり不 連続な値を有し,し かもその値はその分子に固有なもの である有 機吸光光度法で使用する光線のX 1 1 1 x 1 1 1 x = 0 x 3 – 3x 2 = (x 2 ) (x – 1 )2 = 0 全電子エネルギーは E T = 2 ( α 2β)と求められ、 E T < E L となるので 三角形構造の方が安定である。 アリルラジカル CH2CHCH2・ 1 2 3 3つの分子軌道を次のように表す。3 参考図 図1 ベンゼン(左)とシクロブタジエン(右)の分子軌道エネルギー準位。ベンゼンでは全ての電子 が対を作り閉殻構造であるのに対し、シクロブタジエンでは不対電子が2つのジラジカルであ ることが分かる。 a
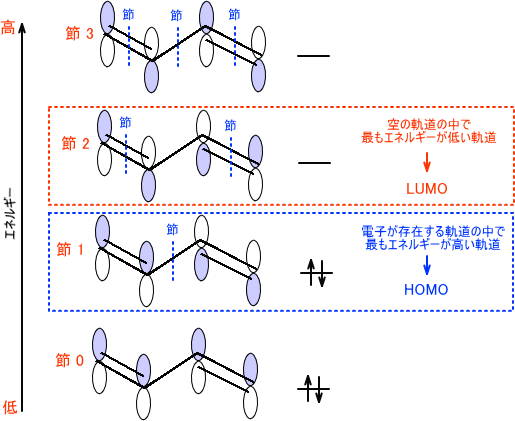
1 3ブタジエン 分子軌道 1 3ブタジエン 分子軌道2711 日本補綴歯科学会第130回記念学術大会 テーマ:食力向上による健康寿命の延伸-補綴歯科の力を示す- 会 期:21年6月18日(金)~日(日) 会 場:Web開催(一部プログラムは東京医科歯科大学 湯島1 2 3 4 BondOrder Matrix 21 31 32 41 42 43 12 4 3 0500 0500 0500 0500 結合次数 1000 π電子密度 1000 1000 1000 π電子密度 結合次数 10 The Hückel method Cyclobutadiene 1 2 4 3 α2β α−2β αα 05p π 3 回答 ブタ1,3ジエンは二重結合が2つあるので、分子軌道は4つ存在する。 とあるのですが、この分子軌道の意味がよくわかりません。 ブタ1,3ジエンは二重結合が2つあるので、分子軌道は4つ存在する。 とあるのですが、この分子軌道の意味がよくわかりません。 軌道エネルギーの小さい状態で結合性軌道のHOMOでない方をとり、もう一段階エネルギーが大きいと
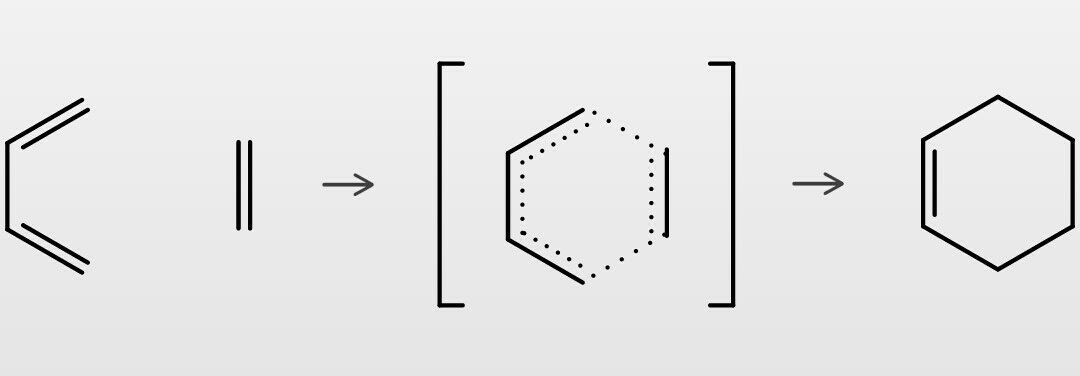
歩いて紡いで もりおか物語 年10月25日(日)午後1:00~1:30 直木賞候補作品となった伊吹有喜さんの『雲を紡ぐ』(文藝春秋社)は、 「歩いておトク」をダウンロード アプリの画面に世界中のステキな風景や観光 1.DielsAlder反応とは 2.DielsAlder反応起こる理由 3.立体保持 4.endo則 それでは順番にいってみよー。 1.DielsAlder反応とは さて名前からだとよくわからないと思うので 超簡単にいってしまうと 以下のように3 単純ヒュッケル法のブタジエンへの適用 31 分子軌道のエネルギーを求める;




Pdfファイル



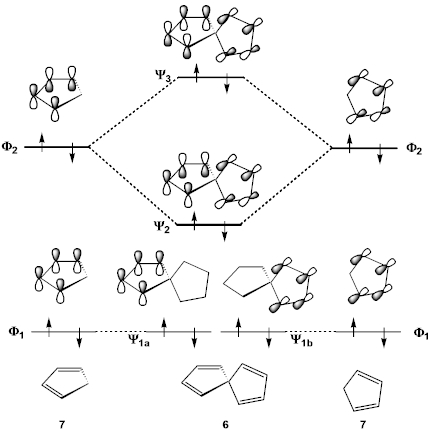
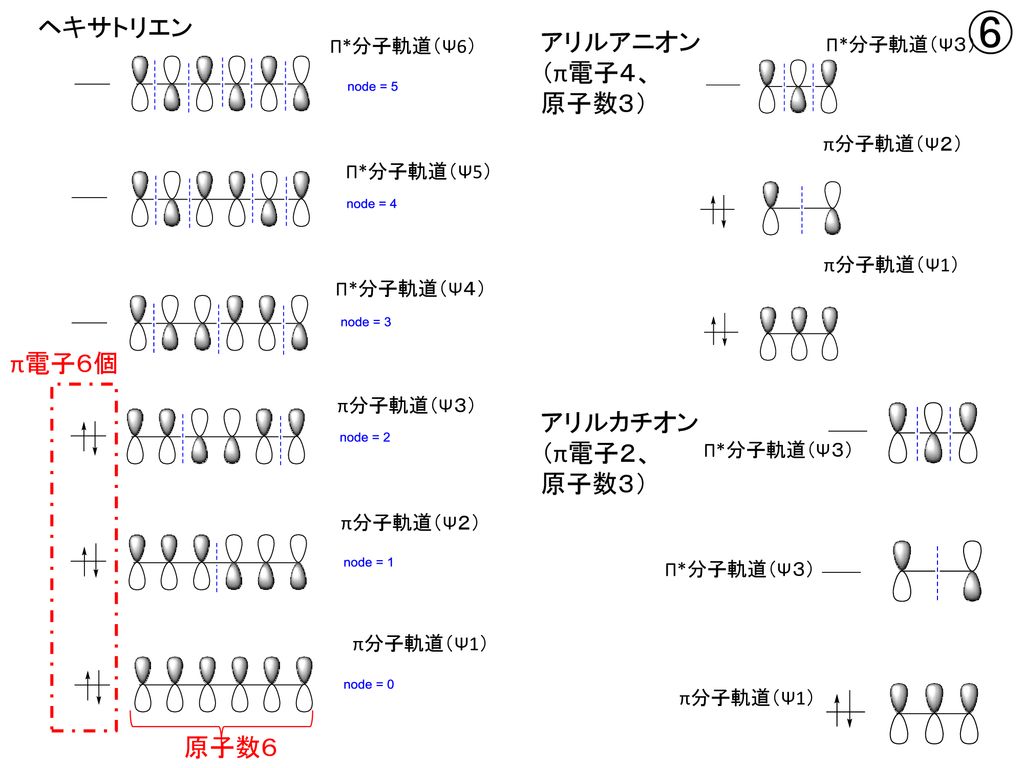
1 3 5 ヘキサトリエン
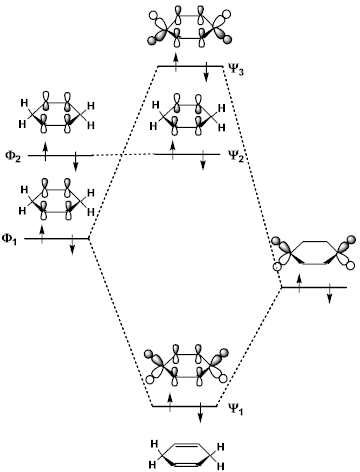
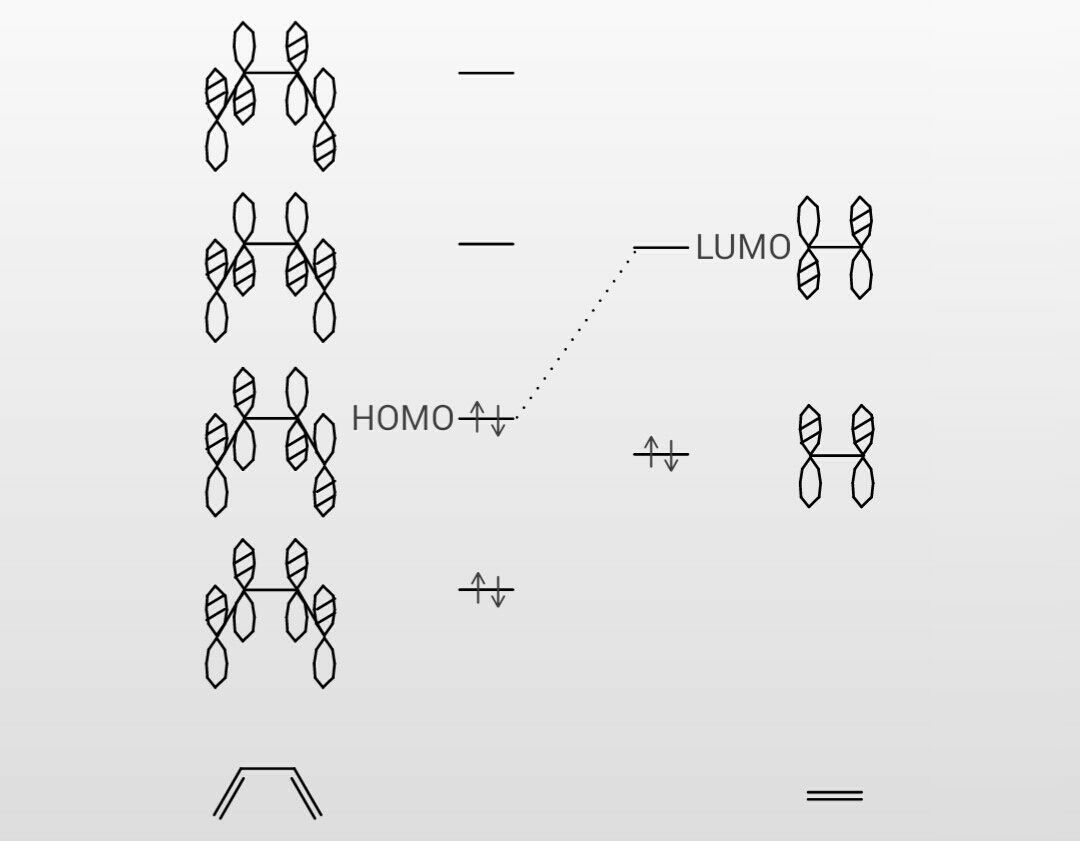
1,3ブタジエン ch 2 =ch–ch=ch 2 の π分子軌道 4個の π軌道からなる系に相当。 連立方程式 (414) は次のようになる – l c 1 c 2 = 0 c 1 – l c 2 c 3 = 0図241 1,3–ブタジエンとエテンの42付加環化反応における HOMO–LUMO相互作用 エテンと1,3–ブタジエンの分子軌道は図314と図52を参照すること. ほとんどのDiels–Alder 反応のジエノフィルは少なくとも一つ電子求引基をもって いる(例:反応244).電子求引基はジエノフィルの LUMOのエネルギーを下げるの で,HOMO–LUMO相互作用が大きくなり,反応が進みやすくなる1,3ブタジエン (4π電子) エテン (2π電子) シクロヘキセン (環化付加物) DielsAlder反応は42環化付加反応である! 4つのπ電子を持つ共役した4つの原子の集団が, 2つのπ電子を持つ二重結合と反応する.



2



Document
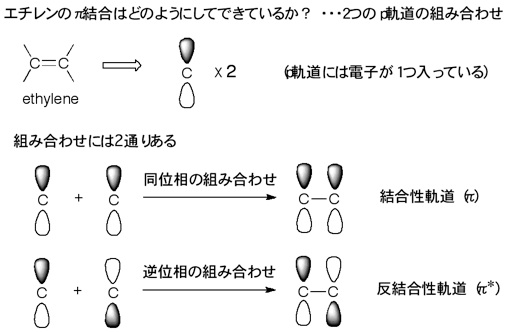
33 分子内反応 ― 一分子求核置換(s n1)反応 分子間反応に対して提案されたフロンティア軌道理論を 分子内反応に応用するには,結合の反応としてみなし結合 性軌道(分子のhomoに相当)と反結合右図は1 つのs 軌道と3 つのp 軌 道が混ざり合ってできるsp3 混成 軌道で,炭素の場合それぞれに電 子1 個が入る。それぞれが水素と 共有結合するとメタン分子が出来, 一つが他の炭素と共有結合すると, エタン分子が出来る。これで分子 の形が説明できる。π電子によって2つの結合性軌道と2つの反結合性軌道ができます。 それぞれの状態がひとつの軌道に対応します。 ひとつの状態には電子が二つしか入りません。 なので横に書くスピンの数がふたつです。 基底状態では1、2の状態に合計4つの電子が入っています。



有機化学者のための分子軌道法




デジタル分子模型で見る化学結合 6 フロンティア分子軌道から 作られる直前の化学結合の様子を見る事ができる
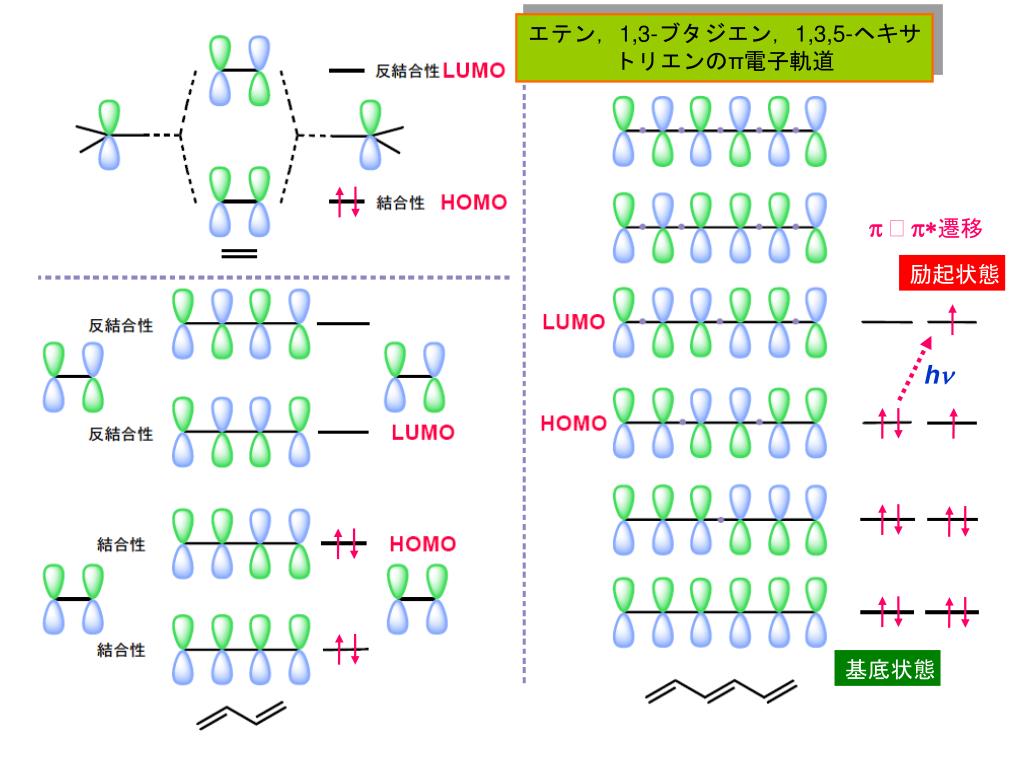
エチレンと1,3ブタジエンもまた、 工業やバイオテクノロジーなどの分野で基本的かつ重要な化学物質である。単純なモデルで考え ると、これら3 つの分子の最高被占軌道(homo)は、o 原子やc 原子上の2p 原子軌道の線形 結合からなる 軌道で表せる。2pz 軌道って、量子力学でp 軌道は3 個 縮退していると習ったけど、そのうちの1 つの軌道のことね。ところでこれらの軌道が重なってできる分 子軌道をなぜπ軌道と呼ぶのかしら。それと電子が6 個というのはどこからでてくるの? • K氏:なぜπか分子軌道法の教材を作成した。 ch 2 ch ch ch ch ch 2 のように,二重結合と単結合が交互にあるような構造を持っている 化合物を共役化合物と呼ぶ。上はヘキサ 1, 3, 5 トリエンの例である。最も単純な共役ジエンであ る1, 3 ブタジエンch 2 ch ch ch



Homoとlumo




第5回
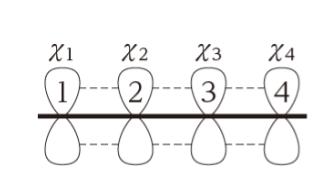
1 3 ブタジエン 分子軌道 Tweet;(/=1 ~ 4) の2p)原子軌道関数を表し,0>0で簡単な系のπ分子軌道(ヒュッケル法) (1)直鎖共役系 エネルギー準位 CH 原子数がnのとき 中心がaで半径2bの円に 内接する正(2n2)角形の 頂点の位置 例)ブタジエン(n = 4) α 軌道(オービタル)の係数の概要 下から順に 左右対称,反対称,対称,... 節(せつ)面(係数の符号が変わる面)が一つずつ増える n = 4 n = 6 n α 2β α−2β (n = 4) n = 2(エテン) n = 3



国家公務員総合職 化学 生物 薬学 H29年 問24解説 薬学 これでok



単純ヒュッケル法による分子軌道の計算と共鳴安定化
ン, トランスー1, 4ポ リブタジエン, アイソタクチック1, 2ポ リブタジエンおよびシンジオタクチック1, 2ポ リブタジエンのような分子構造が立体的に規則正しく配 列された新しいポリブタジエンが製造できるようになっ た高エネルギー状態の分子も電磁波に よって低エネルギー状態への遷移が誘 発され,振動数νの光子を発生すること。 吸収の場合と同じ振動数の電磁波だけ が励起状態を刺激し,低エネルギー状 態に落とすことができる。 Smulated Emission LASER" 13ブタジエンのπ軌道の分子軌道の質問です。光過程による環化反応は同旋的か逆旋的かどちらですか?そしてhomoは下から何番目ですか?電子数 同旋 逆旋4n 熱 光4n+2 光 熱って、



2



脂肪族炭化水素 ジエンの特徴 技術情報館 Sekigin 共役ジエンの特徴に関し 二重結合を 2 つもつジエンの構造と分類 共役系の定義と安定性 共役ジエンの求電子付加反応の特徴 ディールス アルダー付加環化反応を 紹介
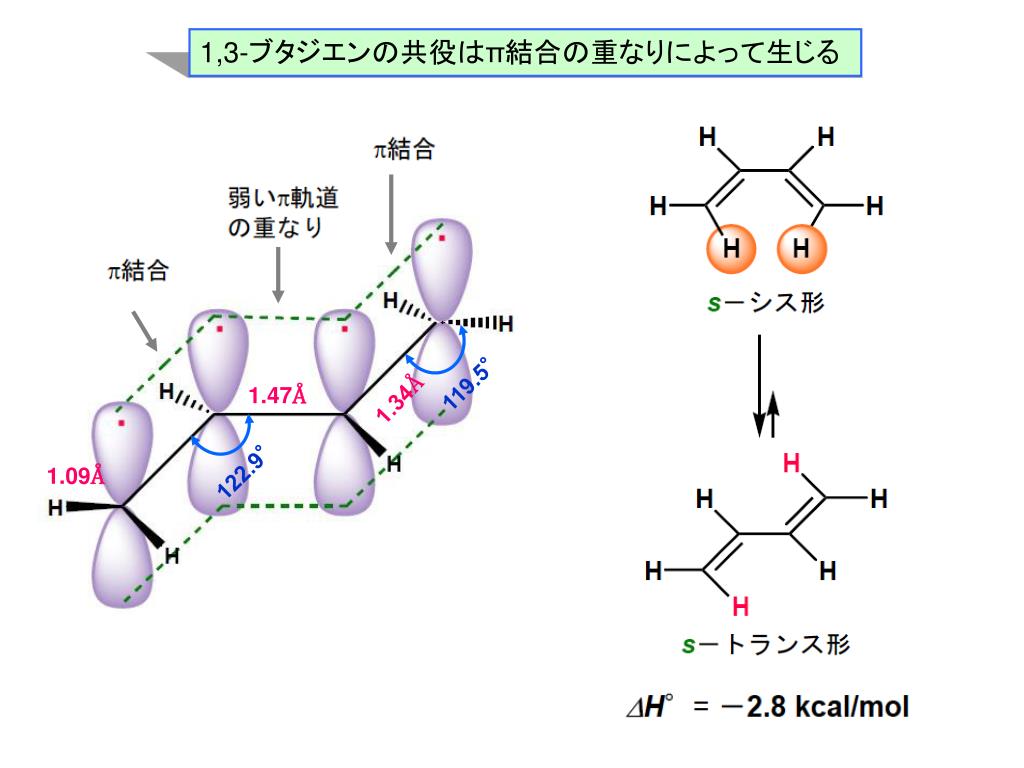
前回は 『共役』について学んだ 以下では、共役ジエンについてのみに絞って復習 1,3ブタジエンを例に考えよう この共鳴構造式から分かること その1 ・真ん中の単結合には、二重結合性がある そのため、共役ジエンの中央の炭素ー炭素結合距離は、 アルカンとアルケンの炭素間距離の中間の値である。 そのため、共役ジエンの配座は大きく分けて2つになる この1,3ブタジエンの分子軌道 c c c c h h h h h h 1,3 1 2 3 4 エネルギー (α+1618β) (α+0618β) (α0618β) (α1618β) 単結合を1本はさんで隣り合う二重結合=共役二重結合 (π電子が非局在化する) 9図1の点群c!"に属する1,3−ブタジエン分子のhomo–1, homo, lumo, lumo1である分子軌道 ' #~' $を,それぞれ炭素原子の2p %原子軌 道の線型結合を用いて' &=∑$' (#&' ' のように記述する.ただし, ' は 図1の炭素原子c!



2



2
Pi はi番目の分子軌道のp番目のp 原子軌道の 係数である。この軌道が次式の分子軌道の方程式を満たすものとする。 ˆ ( 1,2,3, ) F i i i i (2) 軌道エネルギーは次式となる。 ˆ i i i i i F dv dv (3)1,3cyclohexadiene (2 Z,5 E)252,5 octadiene π電子が非局在化しやすい平面形配座 sトランス形 sシス形 ブタジエンのπ分子軌道 E H分子の面に垂直な軌道となっている。π電子の結合 はσ結合に比べ弱くエネルギー準位が深くないために隣の原子へ自由に飛び移る。 ヒュッケル法(Huc kel method) 分子の波動関数を = c1ϕ1 c2ϕ2 c3ϕ3 c4ϕ4 (1) 異なるπ軌道の重なり積分を0とする。(ϕk;ϕ ′ k) = kK′,



結合性軌道と反結合性軌道 Homoとlumo



分子軌道理論 Molecular Orbital Theory Mo理論 Ppt Download
22 分子軌道のエネルギーを求める 221 クーロン積分・共鳴積分・重なり積分; 薬学部CBTの問題です。 問 13ブタジエンは2つの二重結合を持つため、π結合の分子軌道は2つ存在する。 答 誤 13ブタジエンは4つのp軌道をもつため、π結合の分子軌道は4つ形成さ れる。 という問題で、自分は単純に13ブタジエンには2重結合が2つあるので正であると考えました。 なぜπ結合が4つ形成されるのでしょうか?ジエン( diene ) 二重結合を 2つもった炭化水素(一般式 C n H 2n2 )をいう。 なお,3つ以上ある場合はポリエン( polyene )という。なお,1つしかない炭化水素は,既に紹介したアルケンである。 ジエンの分類 ジエンは,不飽和脂肪族の特徴で紹介したように,二重結合の位置と置換基により



Ttf Pc Uec Ac Jp



キリヤ Q A
3 (1)シクロブタジエンにヒュッケル近似を適用し,永年行列式を展開する. 0 0 0 0 0 = − − − − E E E E β β α β α β β α β α β β 0 1 0 1 0 1 1 1 1 0 1 0 1 = x x x x 各要素をβで割って,(αE)/β=xとおくと, ⑰ ⑱ 12 4 3 ブタジエンと違って,C1とC4 が繋がっているので(結合しブタジエン( CH2=CHCH=CH2 ) 本来,電子の運動は,分子全体に広がっている.エネルギーを詳しく議論するには,分子軌道で議論しなければならないが,分子の形や大まかな性質を考える場合には,混成軌道の考えかたのほうが簡単である. 次の例は,分子の骨格を混成軌道法でくみたて,物質の性質を分子軌道法であつかっている. 図 r92 ブタジエン.ブタジエンを



第2節 不飽和炭化水素




書籍紹介 分子軌道法 Pod版 廣田 穰 著 化学




1 3 ブタジエンのp軌道の分子軌道の質問です 光過程による環化反応は 化学 教えて Goo



ディールスアルダー反応 この世を科学的に知ろう



1



2



ブタ1 3ジエンは二重結合が2つあるので 分子軌道は4つ存在する Yahoo 知恵袋



ディールスアルダー反応 この世を科学的に知ろう



2



3




量子力学特論 レポート課題4 17 6 2 Inftyproject Liner Combination Of Atomic Orbital 分子軌道法 シュレディンガ 方程式の Inftyproject 左から Inftyproject をかけて積分を行う Inftyproject よって Inftyproject と書き直せる 但し Inftyproject は全積分



有機反応機構 芳香族求電子置換反応



Ppt 14 章 非局在化した P 電子系 Powerpoint Presentation Id



Note



2



キリヤ Q A




第5回




1 3 ブタジエン




Homo Lumoの概念 結合性軌道 反結合性軌道のエネルギーの違い リョースケ大学



1



2



脂肪族炭化水素 ジエンの特徴 技術情報館 Sekigin 共役ジエンの特徴に関し 二重結合を 2 つもつジエンの構造と分類 共役系の定義と安定性 共役ジエンの求電子付加反応の特徴 ディールス アルダー付加環化反応を 紹介



Ch3 の分子軌道の構築




第5回



分子軌道理論 Molecular Orbital Theory Mo理論 Ppt Download




シクロブタジエン Wikipedia




Homo Lumoの概念 結合性軌道 反結合性軌道のエネルギーの違い リョースケ大学



分子軌道理論 Molecular Orbital Theory Mo理論 Ppt Download



炭化水素の分子軌道模型組立セット 日本スリービー サイエンティフィック



ブタジエンの分子軌道についてなんですが ウォーレンの教科書には画像 Yahoo 知恵袋




ヒュッケル法 前編 手計算で分子軌道を求めてみた Chem Station ケムステ



有機化学者のための分子軌道法



1 3 シクロブタジエンの平衡の式なのですが 真ん中の右上の記号はどういう Yahoo 知恵袋



Ch3 の分子軌道の構築



キリヤ Q A



Chem S U Tokyo Ac Jp



2




有機分子の分子軌道計算と活用 分子軌道法を用いた有機分子の性質と基本的反応の計算と活用 染川 賢一 本 通販 Amazon



2 7 より複雑な分子へ スペクトル色々



2



単純ヒュッケル法による分子軌道の計算と共鳴安定化




第6回



2




最も低いエネルギー分子軌道 Pi1 はそうするだけでした そして 1つが3つのブタジエン分子軌道でした Png 無料ダウンロード Key0



1 3 5 ヘキサトリエン




ブタジエンはp電子が4つあるのに なぜ1の状態をとるときに横に書くスピンは2 Clearnote



2



Ch3 の分子軌道の構築
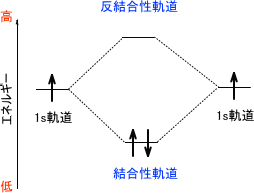



結合性軌道と反結合性軌道 Homoとlumo




ヒュッケル法 前編 手計算で分子軌道を求めてみた Chem Station ケムステ



2



薬学部cbtの問題です 問1 3 ブタジエンは2つの二重結合を持つため Yahoo 知恵袋




ディールス アルダー反応 Wikipedia




日曜化学 3 分子軌道法と可視化 Python Matplotlib Tsujimotterのノートブック



2



分子軌道理論 Molecular Orbital Theory Mo理論 Ppt Download



2



2




ブタジエンはp電子が4つあるのに なぜ1の状態をとるときに横に書くスピンは2 Clearnote



2




分子軌道理論 Molecular Orbital Theory Mo理論 Ppt Download
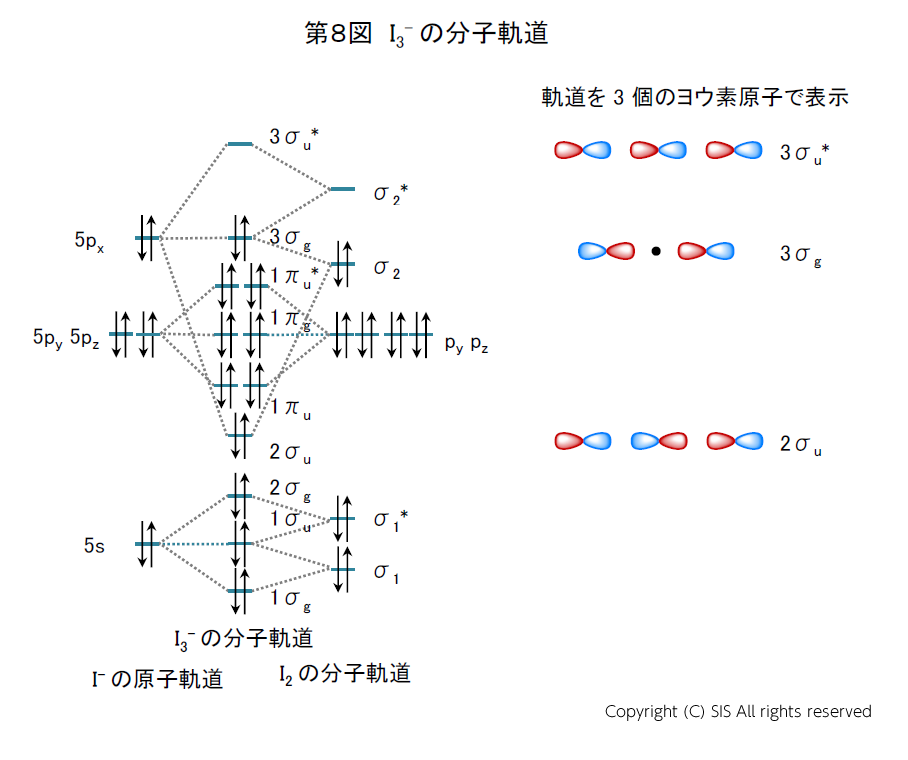



ヨウ素とは ヨウ素学会



単純ヒュッケル法による分子軌道の計算と共鳴安定化



分子軌道法計算 hmo法2 1




14 炭化水素分子内の炭素ー炭素結合と電子 炭素の科学



2



2




ヒュッケルの分子軌道法計算プログラム ヒュッケルの分子軌道法 この言葉は小生にとって大変懐かしい言葉です 初めて耳にした学生時代 ヒュッケル と言う音声にしゃっくりの様な 何か面白みと親しみを感じ また 量子力学のややこしい計算に



2
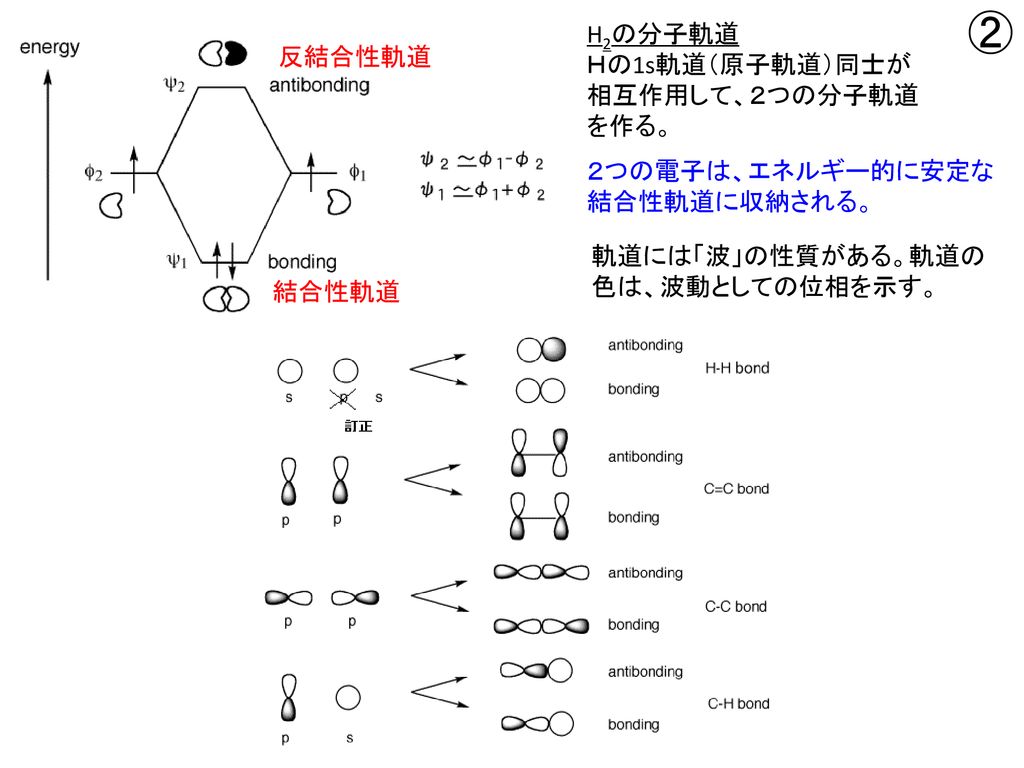



分子軌道理論 Molecular Orbital Theory Mo理論 Ppt Download



2
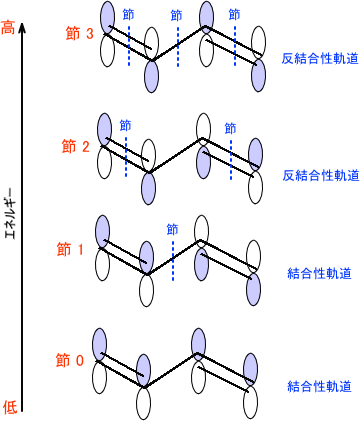



結合性軌道と反結合性軌道 Homoとlumo



2
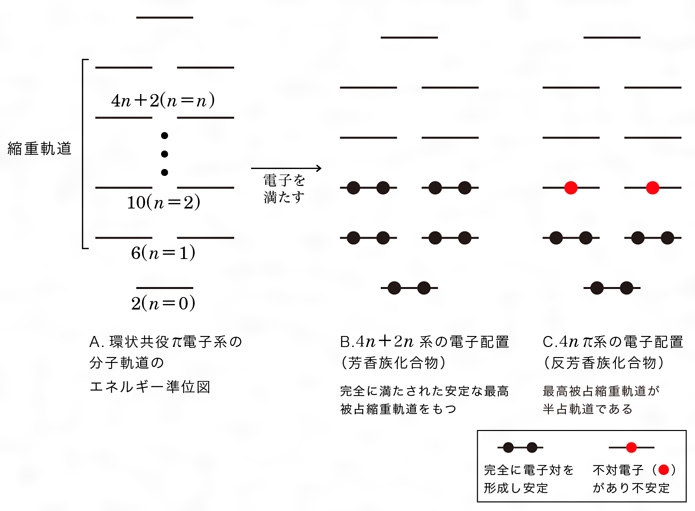



芳香族化合物とは コトバンク



Note



ケトプロフェンの光線過敏症はなぜおこる 薬研
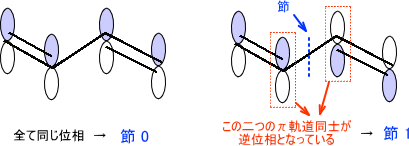



結合性軌道と反結合性軌道 Homoとlumo
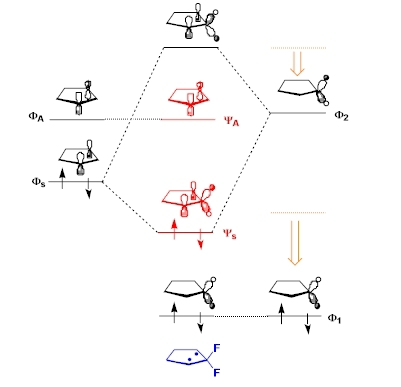



分子軌道法によるスピン多重度 反応性の制御




日曜化学 3 分子軌道法と可視化 Python Matplotlib Tsujimotterのノートブック




有機分子の分子軌道計算と活用 分子軌道法を用いた有機分子の性質と基本的反応の計算と活用 染川 賢一 本 通販 Amazon



放浪者の道標



デジタル分子模型で見る化学結合 6 フロンティア分子軌道から 作られる直前の化学結合の様子を見る事ができる



ブタジエン



Ppt 14 章 非局在化した P 電子系 Powerpoint Presentation Id



単純ヒュッケル法による分子軌道の計算と共鳴安定化



講義 有機化学1 第15回目の講義から 1 分子軌道法について エチレンとブタジエンのp結合について 片桐教授 東京工科大学 工学部 応用化学科 ブログ



0 件のコメント:
コメントを投稿